日本的《药事法》(Pharmaceutical Affairs Law)起源于1943年,主要是对医疗用具在人体的诊断及治疗中的品质、有效性和安全性进行规范。
2002年7月,日本政府宣布全面修订《药事法》,旨在竭力确保医疗器械产品的质量、安全性和有效性。
2014年11月25日本政府再次修订《药事法》形成《日本药品与医疗器械法》(Pharmaceutical and Medical Device Act)。
2014年日本医疗器械与材料的市场总额是325亿美元,其中59%来自于国内产品,41%来自进口。其中占比最大的治疗领域是手术器械与供应(26.3%),紧随其后的是诊断图像系统(14.6%)和人造内部器官与辅助装置(13.3%)。
2018年日本医疗器械市场销售额已激增至478亿美元,增长势头惊人。
今天,日本拥有全球最高的老年人口比例,且其人口持续快速老龄化。以目前的趋势,日本政府预测在2010年到2050年之间的人口数将下降22-23%,而65岁以上的老龄人口比例将上升至40%。
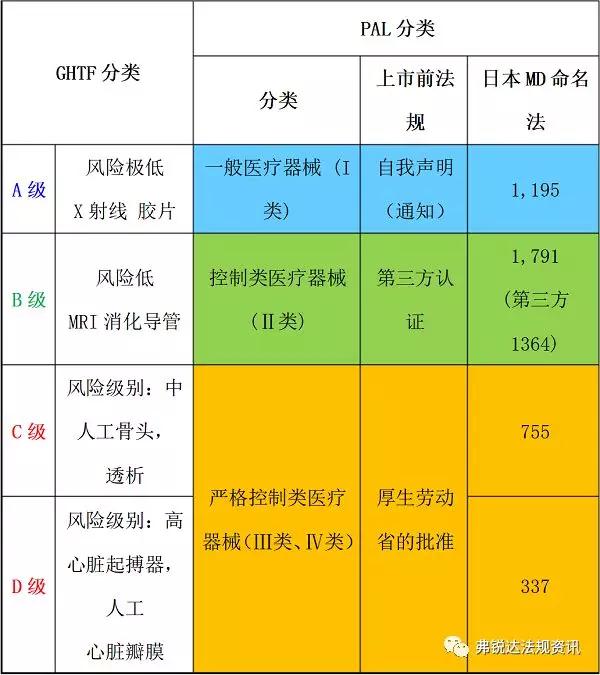
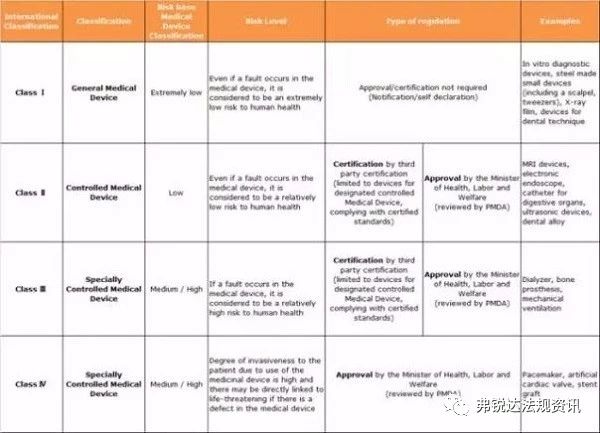
修订后的《药事法》从内容来看,新增新型生物产品管理条例、对低危医疗器械的第三方认证体系,以及厚生劳动省评审高危医疗器械的优先权等。随着《药事法》的修订,厚生劳动省的组织结构也有所变动。这些变动也给评审体系中引进了新方法和新程序,以提高评审工作的质量和效率,并使之与国际上的做法更趋一致。同时,该修订对医疗器械投入市场前准许和入市后管理体系都产生了重大变化。日本医疗器械产品分类采用国际通用的四级分类法,即高度管理医疗器械(Ⅲ类、Ⅳ类)、管理医疗器械(Ⅱ类)、一般医疗器械(Ⅰ类)。一般医疗器械由备案人向审评机构PMDA申请备案;管理医疗器械是在认证基准确定的情况下,由第三方认证机构进行认证,对于没有认证基准的或者不符合认证基准的管理医疗器械,由PMDA进行审评,厚生劳动省(以下简称厚生省)承认;高度管理医疗器械由PMDA进行审评,厚生省承认。但对于有承认基准和审查指导原则的高度管理医疗器械,也可由第三方认证机构进行认证。申请认证的产品如不符合承认基准或审查指导原则,需要向厚生省申请承认。第三方机构必须符合《医疗器械 质量管理体系 用于法规的要求》(ISO13485)中的相关规定,并对医疗器械产业非常熟悉,对加工场所、产品质量等具有丰富经验的专业公司才有资格成为第三方审核机构。产品核准上市后,第三方机构还须负责该产品的事后监督,即质量标准执行情况的检查等工作,而绝不是“一审了之”。厚生省负责对第三方机构资质以及产品审核情况等进行监督管理。一旦发现第三方机构在审核中存在违规操作情况,厚生省有权取消其认证医疗器械产品的资格,并视情节严重程度予以经济处罚。
日本医疗器械产品评估体系与美国的医疗器械产品评估体系相似。例如,厚生省在签批上市许可证之前,首先要对该产品的质量、有效性、安全性等进行综合性评估。其次,主管医疗器械产品审批的政府机构会派人到申请产品上市的生产企业实地了解生产线情况及生产商的资质情况。对于新批准上市的医疗器械产品,监管部门会定期抽查产品进行复核,尤其是拥有新设计、新原理、新结构的创新医疗器械产品,监管部门会在批准其上市4年后再次抽查其产品,并检查其质量、有效性与安全性是否与当初申报时相同;新用途医疗器械产品一般在3年后进行复查。
医疗器械临床试验的监管与药品一致。临床研究开始前30天的书面通告和在试验过程中的不良反应报告都需要严格执行,且需经过审查和监管。值得注意的是,日本将体外诊断产品归为药品,而大多数西方国家将其归类为医疗器械。
体外联合诊断是指可以帮助医生选择对患者最佳的治疗方案的检测,也被称为“个性化治疗”。厚生劳动省发布了一个关于体外联合诊断技术的通告,目的是推广使用相应的产品来加快其发展。在个体联合诊断技术的开发过程中,寻求药品和医疗器械管理局(PMDA)的咨询和建议是非常必要且受到推荐的。事实上,PMDA并不墨守成规的坚持指导原则中的所给出的方法。
一旦新的器械审批获准,必须同时向厚生劳动省提交该器械的保险支付请求。医疗器械和体外诊断产品的保险支付决定将由两个独立的机构进行认定,分别为医疗仪器委员会和日本中央社会保险医疗委员会(Chuikyo)。保险支付系统共分有四个类别和若干子类,分别称为A、B、C和F(图3)。A类和B类适用于已有产品,C类和F类适用于新产品。其中,F类产品不被保险支付体系所覆盖。
为了被全民医保系统(A1,A2或B类)采纳,申请人必须确保其产品在进入该系统后能够立即供应市场。同时,法规规定,在产品更新换代直至被后续产品替代之前,原有的产品必须确保足够的供应。
在参考欧美国家对医疗器械产品上市后监管体系法律法规的基础上,日本政府制定了一套符合本国国情的医疗器械上市后监管体系,最重要的一点是:对于每件获准上市的器械产品,生产商必须保证其质量100%合格,且安全有效;一旦产品上市后被发现存在重大质量问题或安全隐患则由厂商自己负责整改。鉴于此,日本新版医疗器械上市后监管法特别规定:生产商必须建立本公司的质量控制小组和产品安全负责人制度,一旦产品投放市场后出现问题,则这两个小组的负责人将被首先问责。
据了解,日本从2015年开始实施新版《药品医疗器械产品及再生/细胞疗法产品质量安全法》。过去在日本上市的所有医疗器械产品均需持有详细的QMS(质量管理体系)文件,而新版法规则对此作了简化处理——生产商只要有QMS证书并提供产品确实是按照QMS生产的说明即可。但厚生省会对医疗器械厂商进行不定期的飞行检查。

弗锐达小编结束语:
日本是医疗器械的重要市场,日本的老龄化也越来越凸显,老龄化现象激发了对一系列商品和服务的新需求,其中就包括医疗救助技术和家庭医疗保健。
毫无疑问的是,复杂的社会环境对日本政府的医疗器械监管提出了更高的要求。日本当局在过去的几年中开始对其监管法规进行简化,但国外医疗器械想进入日本依然困难,尤其是日本尚不接受欧盟的CE和美国的FDA认证。
弗锐达小编希望,如果大家能更好的理解日本对医疗器械的监管流程,可以减少市场障碍,节约时间,缩减成本和规避风险。

扫一扫 关注我们



